Meldung
Enantioselektiv umlagern, katalysiert durch 1,3,2-Diazaphospholene
Nachrichten aus der Chemie, März 2024, S. 40-43, DOI, PDF. Login für Volltextzugriff.
Von Wiley-VCH zur Verfügung gestellt
Durch asymmetrische reduktive Eschenmoser-Claisen-Umlagerungen reagieren α,β-ungesättigte O-allylische Iminoether (1) zu hochsubstituierten 4-Pentenamiden (3). Die Cramer-Gruppe an der EPFL Lausanne nutzt dafür chirale 1,3,2-Diazaphospholene (2) als Präkatalysatoren. Der aktive Katalysator 2H-Diazaphospholen entsteht, indem (2) mit Phenylsilan reduziert wird. Der Katalysator addiert reduktiv 1,4-konjugiert an (1), wodurch sich ein chirales Ketenaminal-Intermediat bildet. Dieses reagiert in einer asymmetrischen Eschenmoser-Claisen-Umlagerung. Reduktive Spaltung mit PhSiH3 setzt den Katalysator und die Pentenamide (3) frei. Einsetzen lassen sich diese zum Beispiel in einer kurzen Totalsynthese des Alkaloids (+)-Apomorphin oder um Terpenintermediate herzustellen. UJ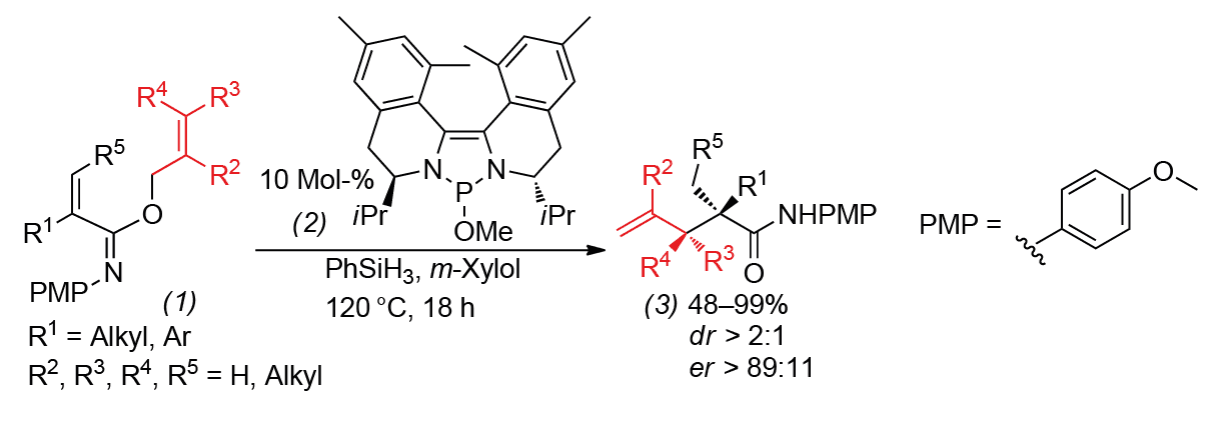
- Science, doi: 10.1126/science.adl3369
Überprüfung Ihres Anmeldestatus ...
Wenn Sie ein registrierter Benutzer sind, zeigen wir in Kürze den vollständigen Artikel.